Tedavilere Dirençli Kanser Kök Hücreleri Nasıl Öldürülür ? - Prof Dr u0735668_canfeza Sezgin
Tamamlayıcı Kanser Tedavisi Kliniği
İmmunoterapi & Derin Doku RF Hipertermi & Fitoterapi & Elektrokemoterapi & Ozon & HBO
Tamamlayıcı kanser tedavileri ile ilgili 02122155027 & 02122155028 & WhatsApp 05052398959 bilgi alınız
Kanser tedavisinde gelişmeler olmasına rağmen birçok hasta temel tedavilerden sonra tekrarlamakta veya tedaviye rağmen çoğalmaya devam etmektedir. Bu durum kanser hücrelerinin kanser tedavisinin öldürücü etkisinden korunup kaçabildiğini göstermektedir (1).
Bunun nedeninin kanseri başlatan ve tekrar çoğalmasını sağlayan Kanser Kök Hücreleri olduğu saptanmıştır (2).
KKH arada sessizce bölünmeden bekleme, kendisinde kanser tedavisinin oluşturduğu hasarı tamir etme yeteneğine sahip hücrelerdir (3, 4).
KKH özellikle kanser kitlesinin oksijeni az olan bölgelerinde yerleşir. Oksijenin azlığı radyoterapi ve kemoterapi gibi kanser tedavilerinin yararını azaltan ve kanser hücresinin yaşama şansını arttıran ortamı oluşturur (5, 6).
Kanser Kök Hücresine Karşı Hipertermi’ nin Yararı
Hipertermi yöntemi, kanser kitlesinin radyoterapi veya kemoterapiye daha iyi yanıt verme amacıyla derin doku RF Onkotermik Hipertermi vs. yöntemlerle yan etki olmadan 40–43⁰ C aralığında ısıtılması işlemidir ve çeşitli kanser tiplerinde etkilidir ( 7 – 10). Tamamlayıcı kanser tedavisi olarak uygulanır.
Kanser kitlesinde kan akımını ve oksijenlenmeyi düzelterek kanser tedavisinin yararını ve iyileşme şansını arttırır (11 – 13).
Kanser hücreleri ve KKH bağışıklık sisteminden kaçma yeteneğine sahiptir. Derin Doku RF Onkotermik Hipertermi, özellikle kanser hücrelerinden HSP70 salgılanmasını arttırarak bağışıklık sistemi tarafından kanser hücrelerinin tanınıp yok edilmesine yardımcı olur (14 – 16).
İn vivo çalışmalarda hiperterminin bağışıklık sisteminin antikanser savaşçısı doğal öldürücü hücrelerin sayısını arttırarak kanser çoğalmasını belirgin engellediği gösterilmiştir (17, 18).
KKH’ nin sahip olduğu kanser tedavisinin hasarını tamir etme yeteneği, hipertermi uygulanması ile engellenmekte ve tıbbi tedavilerin KKH’ ni öldürmesi sağlanmaktadır (19, 20).
Kanser Kök Hücrelerinin Öldürülmesine Yardımcı Diğer Tedaviler
Bitkisel tedaviler (fitoterapi) KKH üzerine etkili olabilmekte ve tıbbi tedavinin başarı şansını arttıracağı ileri sürülmektedir (21). Alınan kanser tedavisi ilaçlarına veya radyoterapiye uygun planlanan bitkisel tedavilerle KKH’ nin öldürülerek tedavinin başarılı olma şansı arttırılabilir.
Hastanın aldığı kanser tedavi şemasının etkisini bozmayacak şekilde ve dozda planlanacak ozon tedavileriyle KKH’ nin korunmasını sağlayan oksijen azlığı düzeltilebilmekte, kanser tedavisinin başarılı olmasına yardımcı olunmaktadır (22, 23).
Ayrıca hipertermi tedavisi ile birlikte yüksek doz C vitaminin toplardamar yoluyla uygulanması gerek hastanın yaşam kalitesinin arttırılması, gerekse bağışıklık sisteminin desteklenmesi açısından büyük önem taşır (24).
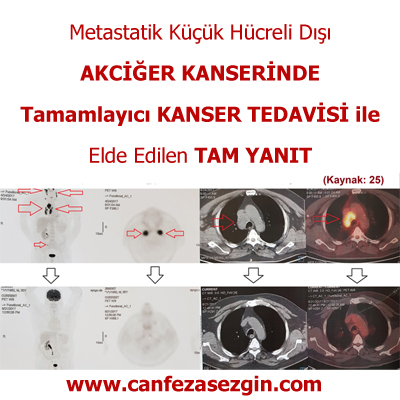
Metastatik küçük hücreli dışı akciğer kanserinin tedavisinde kemoterapi yanı sıra tamamlayıcı derin doku RF Onkotermik hipertermi, fitoterapi ve yüksek doz C vitamini uygulaması ile elde edilen tam yanıt vakası onkoloji kongresinde sunulmuştur (25).
Kaynaklar
1. Bao S, Wu Q, McLendon RE, et al. Glioma stem cells promote radioresistance by preferential activation of the DNA damage response. Nature 2006;444:756–60.
2. Carnero A, Lleonart M. The hypoxic microenvironment: a deter-minant of cancer stem cell evolution. BioEssays: News Rev MolCell Dev Biol 2016;38:S65–S74.
3. Orford KW, Scadden DT. Deconstructing stem cell self-renewal:genetic insights into cell-cycle regulation. Nat Rev Genet2008;9:115–28.
4. Cojoc M, Mabert K, Muders MH, Dubrovska A. A role for cancerstem cells in therapy resistance: cellular and molecular mecha-nisms. Semin Cancer Biol 2015;31:16–27.
5. Gilbertson RJ, Rich JN. Making a tumour's bed: glioblastoma stem cells and the vascular niche. Nat Rev Cancer 2007;7:733–6.
6. Conley SJ, Gheordunescu E, Kakarala P, et al. Antiangiogenic agents increase breast cancer stem cells via the generation of tumor hypoxia. Proc Natl Acad Sci USA 2012;109:2784–9.
7. van der Zee J, Gonzalez Gonzalez D, van Rhoon GC, et al.Comparison of radiotherapy alone with radiotherapy plus hyperthermia in locally advanced pelvic tumours: a prospective, randomised, multicentre trial. Dutch Deep Hyperthermia Group. Lancet 2000;355:1119–25.
8. Colombo R, Salonia A, Da Pozzo LF, et al. Combination of intra-vesical chemotherapy and hyperthermia for the treatment of superficial bladder cancer: preliminary clinical experience. Crit Rev Oncol/Hematol 2003;47:127–39.
9. Issels RD, Lindner LH, Verweij J, et al. Neo-adjuvant chemotherapy alone or with regional hyperthermia for localised high-risk soft-tissue sarcoma: a randomised phase 3 multicentre study. Lancet Oncol 2010;11:561–70.
10. Overgaard J, Gonzalez Gonzalez D, Hulshof MC, et al. Randomised trial of hyperthermia as adjuvant to radiotherapy for recurrent or metastatic malignant melanoma. European Society for Hyperthermic Oncology. Lancet 1995;345:540–3.
11. Sen A, Capitano ML, Spernyak JA, et al. Mild elevation of body temperature reduces tumor interstitial fluid pressure and hypoxia and enhances efficacy of radiotherapy in murine tumor models. Cancer Res 2011;71:3872–80.
12. Winslow TB, Eranki A, Ullas S, et al. A pilot study of the effects of mild systemic heating on human head and neck tumour xenografts: analysis of tumour perfusion, interstitial fluid pressure,hypoxia and efficacy of radiation therapy. Int J Hypertherm 2015;31:693–701.
13. Horsman MR. Realistic biological approaches for improving thermoradiotherapy. Int J Hypertherm 2016;32:14–22.
14. Chen T, Guo J, Han C, et al. Heat shock protein 70, released from heat-stressed tumor cells, initiates antitumor immunity by inducing tumor cell chemokine production and activating dendritic cells via TLR4 pathway. J Immunol 2009;182:1449–59.
15. Bleifuss E, Bendz H, Sirch B, et al. Differential capacity of chaperone-rich lysates in cross-presenting human endogenous andexogenous melanoma differentiation antigens. Int J Hypertherm2008;24:623–37.
16. Schueller G, Stift A, Friedl J, et al. Hyperthermia improves cellular immune response to human hepatocellular carcinoma subsequent to co-culture with tumor lysate pulsed dendritic cells. IntJ Oncol 2003;22:1397–402.
17. Burd R, Dziedzic TS, Xu Y, et al. Tumor cell apoptosis, lymphocyte recruitment and tumor vascular changes are induced by low temperature, long duration (fever-like) whole body hyperthermia. J Cell Physiol 1998;177:137–47.
18. AL Oei, LEM Vriend, PM Krawczyk, MR Horsman, NAP Franken, J Crezee. Targeting therapy-resistant cancer stem cells by hyperthermia, InternationalJournal of Hyperthermia 2017;33(4): 419-427.
19. Pelicci PG, Dalton P, Orecchia R. Heating cancer stem cells to reduce tumor relapse. Breast Cancer Res: BCR 2011;13:305.
20. van Oorschot B, Granata G, Franco Ten Cate DS, et al. Targeting DNA double strand break repair with hyperthermia and DNA-PKcs inhibition to enhance the effect of radiation treatment. Oncotarget 2016;7:65504–13.
21. Taylor WF, Jabbarzadeh E. The use of natural products to target cancer stem cells. American Journal of Cancer Research. 2017;7(7):1588-1605.
22. Luongo M, Brigida AL, Mascolo L, Gaudino G. Possible Therapeutic Effects of Ozone Mixture on Hypoxia in Tumor Development. Anticancer Res February 2017 37 (2) 425-435.
23. Clavo B, Pérez JL, López L, et al. Ozone Therapy for Tumor Oxygenation: a Pilot Study. Evidence-based Complementary and Alternative Medicine. 2004;1(1):93-98.
24. Campbell JD, Cole M, Bunditrutavorn B, Vella AT. Ascorbic acid is a potent inhibitor of various forms of T cell apoptosis. Cell Immunol. 1999;194(1):1-5.
25. u0735668_canfeza Sezgin, Metastatik küçük hücreli dışı akciğer kanserinde tamamlayıcı kanser tedavisi ile elde edilen tam yanıt. 16-18 Mart 2018, 4.Ege Hematoloji Onkoloji Kongresi, Çeşme - İzmir