 Son yıllarda kanser sürecinin düzenlenmesi, kendisine karşı kullanılan tedavilere adaptasyonu ve direnç geliştirmesi, kanser hücrelerinin kendileri ve normal hücreler ile iletişimleri hakkında daha fazla bilgiye sahibiz. Kanser hücreleri kendi iç dinamikleri ile hareket ederken aynı zamanda çevredeki sağlıklı hücrelerle de ilişkiye girmekte, bazen onların da işlevlerini bozarak kendileri için enerji üretimini sağlayan köle hücreler haline gelmelerini sağlamaktadır.
Son yıllarda kanser sürecinin düzenlenmesi, kendisine karşı kullanılan tedavilere adaptasyonu ve direnç geliştirmesi, kanser hücrelerinin kendileri ve normal hücreler ile iletişimleri hakkında daha fazla bilgiye sahibiz. Kanser hücreleri kendi iç dinamikleri ile hareket ederken aynı zamanda çevredeki sağlıklı hücrelerle de ilişkiye girmekte, bazen onların da işlevlerini bozarak kendileri için enerji üretimini sağlayan köle hücreler haline gelmelerini sağlamaktadır.
Normalde bağışıklık sistemi (immun sistem) hücreleri, anormal yapıları ortadan kaldırırken, kanser hücreleri bu saldırıdan kurtulmanın çeşitli yollarını genetik mutasyonlar yoluyla sağlayabilmektedir. Bu sayede bağışıklık sisteminin (immun sistem) denetiminden kaçan kanser hücreleri kendilerine bir koloni kurarak kendi mikroçevrelerini kurarlar.
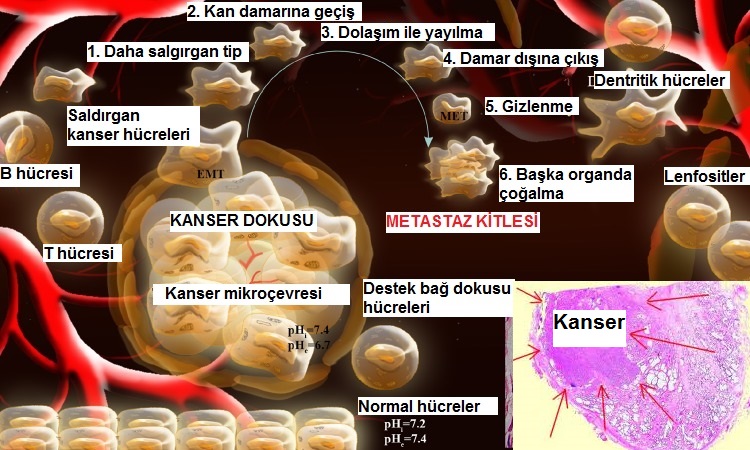
Ekteki resimde kanser hücrelerinin başlangıç odağı olan kanser dokusundan ayrılıp kan damarı içine göç etmeleri, bağışıklık sisteminden kaçmaları, dolaşımda yayılıp kan damarı dışına çıkmaları ve burada gizlenerek bir süre saklanmaları, daha sonra göç ettikleri bölgede tekrar çoğalmaya başlayarak metastaz kitlesini oluşturmaları basit olarak şematize edilmektedir. Bu süreç çok karışık ve uzun yıllar alan bir süredir. Bazı kanser türlerinde ise aylar içinde bunun gelişebildiğini biliyoruz. Aynı resimde kanser hücrelerinin ve normal sağlıklı hücrelerin hücre içi ve hücre dışı alandaki pH değerleri verilmektedir. Kanser hücrelerinin hücre dışı pH değerinin asidik olduğunu görmekteyiz.
Kanser hücreleri hücre dışı sıvının pH düzeyinin değiştirilmesi (asitleştirmesi), çevresindeki normal destek doku hücrelerinin (fibroblast) kendi çıkarları doğrultusunda kullanılması (köleleştirme), bağışıklık sisteminin devre dışı bırakılması (immun-escape fenomeni) ve beslenme için kendi damar sistemini oluşturması (anjiyojenezis) gibi çeşitli özelliklere sahiptir (1).
Bir çok kemoterapi ilacı olmasına rağmen kanser hücrelerinin ortadan kaldırılamadığı veya bir bölümünün dirençli olması nedeni ile kanserin tekrar büyümeye başladığı iyi bilinmektedir. Bunun çeşitli nedenleri bulunmaktadır. Kemoterapiye karşı yanıtsızlığın yani direncin bir nedeni de kanser hücrelerinin ortamın pH’ sını değiştirerek asitleştirme yeteneğine sahip olmasıdır. Özellikle tümör kitlelerinde oksijen azlığı ve değişen metabolizma nedeni ile kanser hücreleri hücre dışı ortamda belirgin olmak üzere asidoz gelişimine neden olur (2).
Normal hücrelerde hücre içi pH 6.99-7.20 iken kanser hücrelerinde hücre içi pH 7.12-7.56 arasında değişmektedir. Normal hücrelerde hücrenin dışındaki pH 7.3-7.4 iken kanser hücrelerinin dışındaki pH asidik olup 6.2-6.9 arasındadır. Hücre dışında belirginleşen asidoz, hücre içi ve hücre dışı asit dengesini bozar. Antrasiklin, vinka alkoloidleri ve taksanlar gibi hafif bazik olan kemoterapi ilaçlarının daha asidik olan kanser hücresi dışında birikmesine neden olarak ilaçların kanser hücrelerine girmesini ve yararını engeller (2 - 4).
Kanser hücrelerinde ortamın asitleştirilmesine yarayan çeşitli pompalar bulunmaktadır. Özellikle kanser ilaçlarına karşı dirençli olan meme kanseri, baş-boyun kanserleri, karaciğer kanseri (hepatosellüler kanser), kalınbağırsak (kolon) kanseri, melanom, yumurtalık (over) kanseri, pankreas kanseri ve prostat kanseri gibi çok çeşitli kanser hücrelerinde bu pompalar bulunmaktadır (5-12). Bu pompalar sayesinde kanser hücreleri kendilerine bir tür kimyasal zırh yaparlar. Kanser tedavisine karşı direnç oluşturan bu zırhın kırılmasında bu pompaların etkilerini engelleyen ilaçların yararlı olabileceği ile ilişkili giderek artan sayıda makale yayımlanmaktadır (13 – 15). Hatta yeni araştırmalar düşük doz kemoterapi, bikarbonat tedavisi ve kanser hücrelerinin çevresini asitleşmeye neden olan pompalarını engelleyen ilaçların birlikte kullanılması ile kanserli hayvanların daha uzun süre yaşadığı gösterilmiştir (16). Kanser hücrelerinin üzerindeki asit pompalarının engellenmesi ile kanser hücrelerinin içi ile dışı arasındaki pH farkı giderilmekte, kanser ilaçlarına karşı zırh gibi koruyucu kalkan oluşturan asidik ortamın oluşması engellenmektedir. Ayrıca ilaç direncine neden olan genlerin yapımı da baskılanabilmektedir (5 – 11).
Asitleştirme pompalarının engellenmesi ve alkali tedaviler kalınbağırsak (kolon), yumurtalık (over), yemek borusu (özefagus), karaciğer kanseri (hepatoblastoma), meme kanseri gibi kanserlerde kanser ilaçlarının etkinliğini arttırmada yararlı olabileceği gösterilmiştir (17 – 20).
Kanser hücrelerinin asit üretimini sağlayan pompaların engellenmesinin yemek borusu ve akciğer kanseri hücrelerinin metastaz yapma yeteneğini azaltabildiği gösterilmiştir (21, 22).
Kanser hücrelerinin dışında bulunan asidik ortam, daha saldırgan kanser tipiyle, metastaz yapma yeteneğinin yüksekliği ile, kemoterapi ve radyoterapi gibi kanser tedavisine yanıt vermemesiyle ilişkilidir bu nedenle çok önemlidir (23). Yapılan bilimsel araştırmalar tıbbi müdahaleler ile kanserli dokuda pH düzeyinin alkali yapılarak kemoterapinin etkinliğinin arttırılabileceğini göstermiştir (24).
Kemoterapinin yararını arttırabildiğini gösteren çok sayıda çalışma olması nedeni ile kanser tedavisinde kemoterapinin yanında tamamlayıcı olarak asit üretimini sağlayan pompaları engelleyen tedavilerin, ağız ve damar yoluyla uygulanacak alkali tedavilerin ciddi faydaları olabilecek yardımcı bir tedavi olarak öne çıkmasını sağlamaktadır. Genel durumu bozuk, standart doz kemoterapi tedavilerini kaldıramayacak kanser hastalarında düşük doz yani metronomik kemoterapinin ağız yoluyla uygulanması yanı sıra alkali ve pH temelli kanser tedavisi hastalığın kontrol altına alınmasını sağlayabilir.
Kanser tedavisinde bilimsel tedaviler yanı sıra tedavi başarısını arttırmada tamamlayıcı tedavilerin önemli olduğunu gösteren çok sayıda bilimsel makale bulunmaktadır. Uygun hastalarda alkali ve pH temelli tedaviler yapılabilir. Bilimsel verilerin kuvvetli olması ve tecrübeler bu düşünceyi pekiştiriyor. Kanser tedavisini planlamada kanserin tipine uygun alkali beslenmenin planlanması yanı sıra tamamlayıcı tedavi olarak kanser hücrelerinin asit üretiminin engellenmesi, bikarbonat tedavileri, kanser tedavisine yanıtın arttırılması, yaşam kalitesinin iyileştirilmesinde, bağışıklık sisteminin desteklenmesinde kişiye özel yardımcı tedaviler kullanılmaktadır. Bu tür tedavi planlamaları kişiye özel tedavi planlamamın temelini oluşturmakta ve bilimsel araştırmalar giderek artan oranda bunu desteklemektedir. Fakat sağlıklı insanların yazılı ve görsel mecrada belirtilen alkali yapıcı ürünler kullanılmasının uygun değildir. Alkali beslenme tarzı zaten doğanın gereği sağlıklı beslenmenin temelini oluşturur. Kanser gibi hastalıklarda ise kanseri hücresinin sahip olduğu asidik zırha karşı beslenme harici tıbbi tedaviler de gereklidir. Bu tedaviler de mutlaka onkoloji uzmanının denetiminde olmalıdır.
Her hastanın evresi ne olursa olsun tedavi olma şansının olduğuna dair çok sayıda hasta sunumları literatürde bulunmaktadır. Bilimin doktorlara getirdiği yeni tedavi açılımlarının hastalara uygun bir şekilde uyarlanmasının daha iyi sonuçlar alınmasını sağlayacağı düşünülmektedir.
Kaynaklar:
1. Martinez-Outschoorn UE, Cell Cycle, 9:16, 3276-3296.
2. Spugnini EP, J Exp Clin Cancer Res 2010,8:44.
3. De Milito A, Cancer Res 2007, 67:5408–5417.
4. Raghunand N, Biochem Pharmacol 2003, 66:1219–1229.).
5. You H, Cancer Lett 2009, 280:110–119.
6. Hinton A, J Biol Chem 2009, 284:16400–16408.
7. Otero-Rey EM, Oral Oncol 2008, 44:193–199.
8. Pérez-Sayáns M, Cancer Treat Rev 2009, 35:707–713.
9. Lu X, Cancer Res 2005, 65:6843–6849.
10. Chung C, Lab Invest 2011,91:732–743.
11. Xu X, J Cell Biochem 2012, 113:2356–2363.
12. Luciani F, J Natl Cancer Inst 2004, 96:1702–1713.
13. Michel V, Int J Cancer 2012,132:1–10.
14. Martínez-Zaguilán R, Biochem Pharmacol 1999, 57:1037–1046.
15. Hernandez A, Curr Pharm 2012, 18:1383–1394.
16. Spugnini et al. Journal of Translational Medicine 2014, 12:225.
17. Luciani F, J Natl Cancer Inst 2004,96:1702–1713.
18. Yeo M, Clin Cancer Res 2004, 10:8687–8696.
19. Morimura T, Pediatr Surg Int 2008, 24:1087–1094.
20. Jin UH, BMC Cancer. 2014 Jul 9;14:498.).
21. Lindner et al. Journal of Experimental & Clinical Cancer Research 2014, 33:73.
22. Supino R, J Pharmacol Exp Ther 2008, 324:15–22.).
23. Calorini L, Exp Oncol 2012, 34:79–84.
24. Raghunand N, Br J Cancer. 1999 Jun;80(7):1005-11.